สูตรเคมีแบ่งเป็น 3 ประเภท คือ
1. สูตรโมเลกุล (Molecular) เป็นสูตรที่เขียนขึ้นเพื่อแสดงให้ทราบว่าสารนั้น 1 โมเลกุลประกอบด้วย ธาตุใดบ้างอย่างละกี่อะตอม เช่น
น้ำ มีสูตรโมเลกุลเป็น H2O หมายความว่า น้ำ 1 โมเลกุล ประกอบด้วยไฮโดรเจน 2 อะตอม และ ออกซิเจน 1 อะตอม
เอทานอล มีสูตรโมเลกุลเป็น C2H6O หมายความว่า เอทานอล 1 โมเลกุล ประกอบด้วย
คาร์บอน 2 อะตอม ไฮโดรเจน 6 อะตอม และ ออกซิเจน 1 อะตอม
กรดซัลฟิวริก มีสูตรโมเลกุลเป็น H2SO4 หมายความว่า กรดซัลฟิวริก 1 โมเลกุล ประกอบด้วย
ไฮโดรเจน 2 อะตอม , ซัลเฟอร์ 1 อะตอม และ ออกซิเจน 4 อะตอม
แคลเซียมฟอสเฟต มีสูตรโมเลกุลเป็น Ca3(PO4 )2 หมายความว่า แคลเซียมฟอสเฟต 1 โมเลกุล ประกอบด้วยแคลเซียม 3 อะตอม , ฟอสฟอรัส 1 X 2 =2 อะตอม และ ออกซิเจน 4 X 2 =8 อะตอม
ตัวอย่างอื่น ๆ ของสูตรโมเลกุล ได้แก่
น้ำตาลกลูโคส มีสูตรโมเลกุล C6H12O6
น้ำ มีสูตรโมเลกุล H2O
โพรเพน มีสูตรโมเลกุล C3H8
เบนซีน มีสูตรโมเลกุล C6H6
2. สูตรเอมพิริคัลหรือสูตรอย่างง่าย (Empirical formular) เป็นสูตรที่เขียนขึ้นเพื่อแสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุใดบ้าง ขณะเดียวกันก็ยังแสดงอัตราส่วนอย่างต่ำที่สุดของจำนวนอะตอมที่ปรากฏในสูตรนั้นด้วย ส่วนใหญ่ใช้แสดงสูตรของสารประกอบไอออนิกซึ่งไม่มีสูตรโมเลกุลที่แน่นอน
เช่น โซเดียมคลอไรด์มีสูตรเป็น NaCl
นอกจากนี้ยังอาจใช้แสดงอัตราส่วนอย่างต่ำของสารโคเวเลนต์ด้วย
เช่น ไฮโดรเจนเปอร์ออกไซด์ มีสูตรเป็น H2O2 มีสูตรเอมพิริคัลเป็น HO
กรดซัลฟิวริก มีสูตรโมเลกุลเป็น H2SO4 หมายความว่า กรดซัลฟิวริก 1 โมเลกุลประกอบด้วย
ธาตุ H , S และ O โดยมีอัตราส่วนอย่างต่ำของจำนวนอะตอม H : S : O = 2 : 1 : 4
น้ำตาลกลูโคส มีสูตรโมเลกุลเป็น C6H12O6 หมายความว่า น้ำตาลกลูโคส 1 โมเลกุล ประกอบด้วย
ธาตุ C , H และ O โดยมีอัตราส่วนอย่างต่ำของจำนวนอะตอม C : H : O = 1 : 2 : 1
เอทานอล มีสูตรโมเลกุลเป็น C2H6O หมายความว่า เอทานอล 1 โมเลกุล ประกอบด้วย
ธาตุ C , H และ O โดยมีอัตราส่วนอย่างต่ำของจำนวนอะตอม C : H : O = 2 : 6 : 1
ธาตุ H , S และ O โดยมีอัตราส่วนอย่างต่ำของจำนวนอะตอม H : S : O = 2 : 1 : 4
น้ำตาลกลูโคส มีสูตรโมเลกุลเป็น C6H12O6 หมายความว่า น้ำตาลกลูโคส 1 โมเลกุล ประกอบด้วย
ธาตุ C , H และ O โดยมีอัตราส่วนอย่างต่ำของจำนวนอะตอม C : H : O = 1 : 2 : 1
เอทานอล มีสูตรโมเลกุลเป็น C2H6O หมายความว่า เอทานอล 1 โมเลกุล ประกอบด้วย
ธาตุ C , H และ O โดยมีอัตราส่วนอย่างต่ำของจำนวนอะตอม C : H : O = 2 : 6 : 1
ตัวอย่างของสูตรเอมพิริคัล ได้แก่
น้ำตาลกลูโคส มีสูตรเอมพิริคัล CH2O
น้ำ มีสูตรเอมพิริคัล H2O
โพรพีน มีสูตรเอมพิริคัล CH2
เบนซีน มีสูตรเอมพิริคัล CH
น้ำตาลกลูโคส มีสูตรเอมพิริคัล CH2O
น้ำ มีสูตรเอมพิริคัล H2O
โพรพีน มีสูตรเอมพิริคัล CH2
เบนซีน มีสูตรเอมพิริคัล CH
สูตรโมเลกุลเป็นสูตรที่แสดงจำนวนอะตอมทั้งหมดใน 1 โมเลกุล ในขณะที่สูตร
เอมพิริคัลแสดงอัตราส่วนอย่างต่ำของจำนวนอะตอมใน 1 โมเลกุล จะเห็นได้ว่าถ้าหากทราบสูตรโมเลกุลจะทำให้ทราบสูตรเอมพิริคัล เนื่องจากสูตรทั้งสองประเภทมีส่วนสัมพันธ์กันดังนี้
สูตรโมเลกุล = (สูตรเอมพิริคัล) n เมื่อ n คือเลขจำนวนเต็ม = 1, 2, 3, 4…..
3. สูตรโครงสร้าง (Structural formular) เป็นสูตรที่เขียนขึ้นเพื่อแสดงให้ทราบว่าสารนั้น 1 โมเลกุล ประกอบด้วย ธาตุใดบ้างอย่างละกี่อะตอม และอะตอมใดเกาะเกี่ยวอยู่กับอะตอมใดด้วยพันธะชนิดใด
เอมพิริคัลแสดงอัตราส่วนอย่างต่ำของจำนวนอะตอมใน 1 โมเลกุล จะเห็นได้ว่าถ้าหากทราบสูตรโมเลกุลจะทำให้ทราบสูตรเอมพิริคัล เนื่องจากสูตรทั้งสองประเภทมีส่วนสัมพันธ์กันดังนี้
สูตรโมเลกุล = (สูตรเอมพิริคัล) n เมื่อ n คือเลขจำนวนเต็ม = 1, 2, 3, 4…..
3. สูตรโครงสร้าง (Structural formular) เป็นสูตรที่เขียนขึ้นเพื่อแสดงให้ทราบว่าสารนั้น 1 โมเลกุล ประกอบด้วย ธาตุใดบ้างอย่างละกี่อะตอม และอะตอมใดเกาะเกี่ยวอยู่กับอะตอมใดด้วยพันธะชนิดใด
ตัวอย่าง O = C = O เป็นสูตรโครงสร้างของคาร์บอนไดออกไซด์ (CO2) ซึ่งบอกให้ทราบว่าหนึ่งโมเลกุลของคาร์บอนไดออกไซด์ ประกอบด้วย C 1 อะตอม และ O 2 อะตอม ระหว่าง C และ O ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ชนิดพันธะคู่
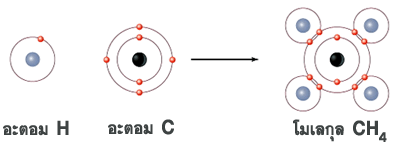
สารประกอบเกิดขึ้นจากการแลกเปลี่ยนอนุภาคมูลฐานภายในอะตอม เพื่อให้อยู่ในสภาพที่เสถียรหรือสมดุล จึงเกิดเป็นโมเลกุลและสูตรสารเคมีต่างๆ ดังภาพ
น้ำ (H2O) ประกอบด้วยธาตุไฮโดรเจน และออกซิเจน โดยมีอัตราส่วนโดยอะตอมของ H : O = 2 : 1, มีอัตราส่วนโดยมวลของ H : O = 1 : 8 และ มีอัตราส่วนโดยปริมาตรของ H : O = 2 : 1
คาร์บอนไดออกไซด์ (CO2) ประกอบด้วยธาตุคาร์บอนและออกซิเจน โดยมีอัตราส่วนโดยอะตอมของ C : O = 1 : 2 และ มีอัตราส่วนโดยมวลของ C : O = 3 : 8
ดังนั้น สูตรเคมี คือ กลุ่มของสัญลักษณ์ธาตุที่เขียนขึ้นเพื่อแสดงจำนวนอะตอมของธาตุที่เป็นองค์ประกอบของสาร สูตรเคมีที่แสดงชนิดของธาตุและจำนวนอะตอมที่เป็นองค์ประกอบใน 1 โมเลกุล เรียกว่า "สูตรโมเลกุล" ดังตัวอย่างสูตรโมเลกุลของสารประกอบต่อไปนี้ ตัวอย่างสูตรโมเลกุลของสารประกอบ
แมงกาเนต