|
วันจันทร์ที่ 4 สิงหาคม พ.ศ. 2557
พันธะไออนิก
พันธะไอออนิก
พันธะไอออนิก (อังกฤษ: ionic bond) เกิดจากที่อะตอมหรือกลุ่มของอะตอมสร้างพันธะกันโดยที่อะตอมหรือกลุ่มของอะตอมให้อิเล็กตรอนกับอะตอมหรือกลุ่มของอะตอม ทำให้กลายเป็นประจุบวก ในขณะที่อะตอมหรือกลุ่มของอะตอมที่ได้รับอิเล็กตรอนนั้นกลายเป็นประจุลบ เนื่องจากทั้งสองกลุ่มมีประจุตรงกันข้ามกันจะดึงดูดกัน ทำให้เกิดพันธะไอออน โดยทั่วไปพันธะชนิดนี้มักเกิดขึ้นระหว่างโลหะกับอโลหะ โดยอะตอมที่ให้อิเล็กตรอนมักเป็นโลหะ ทำให้โลหะนั้นมีประจุบวก และอะตอมที่รับอิเล็กตรอนมักเป็นอโลหะ จึงมีประจุลบ ไอออนที่พันธะไอออนมีความแข็งแรงมากกว่าพันธะไฮโดรเจน แต่แข็งแรงพอ ๆ กับพันธะโคเวเลนต์
IUPAC นิยามพันธะไอออนิกว่าเป็น "พันธะระหว่างอะตอมที่มีอิเล็กโทรเนกาทิวิตีต่างกันอย่างมาก" ในที่นี้ พันธะไอออนิก หมายถึง แรงยึดเหนี่ยวทางไฟฟ้าสถิตที่เกิดขึ้นระหว่างประจุไฟฟ้าของไอออนบวกและไอออนลบ ซึ่งแตกต่างเปรียบเทียบกับพันธะโคเวเลนต์อย่างแท้จริง ในทางปฏิบัติ เรามักจะพิจารณาค่าความเป็นไอออนิกของพันธะ มากกว่าที่จะบอกว่าเป็นพันธะไอออนิกหรือพันธะโคเวเลนต์อย่างแท้จริง
 การจัดเรียงอิเล็กตรอน ของ ลิเทียม และ ฟลูออรีน ลิเทียมมีอิเล็กตรอน 1 ตัวในวงโคจรชั้นนอกสุดของมันซึ่งอยู่อย่างหลวมๆ เพราะว่า พลังงานไอออไนเซชัน ต่ำ ฟลูออรีนมีอิเล็กตรอน 7 ตัวในวงโคจรชั้นนอกสุด เมื่ออิเล็กตรอน 1 ตัว เคลื่อนที่จากลิเทียมไปยังฟลูออรีน แต่ละ ไอออน จะจัดเรียงตัวกันแบบ ก๊าซมีตระกูล พลังงานพันธะจาก แรงดึงดูดไฟฟ้าสถิต ของสองประจุไออนที่ตรงข้ามกันมีค่าเป็นลบมากพอ เนื่องจากการที่พลังงานในสถานะที่เป็นพันธะโดยรวมต่ำกว่าสถานะที่ไม่เป็นพันธะ
การจัดเรียงอิเล็กตรอน ของ ลิเทียม และ ฟลูออรีน ลิเทียมมีอิเล็กตรอน 1 ตัวในวงโคจรชั้นนอกสุดของมันซึ่งอยู่อย่างหลวมๆ เพราะว่า พลังงานไอออไนเซชัน ต่ำ ฟลูออรีนมีอิเล็กตรอน 7 ตัวในวงโคจรชั้นนอกสุด เมื่ออิเล็กตรอน 1 ตัว เคลื่อนที่จากลิเทียมไปยังฟลูออรีน แต่ละ ไอออน จะจัดเรียงตัวกันแบบ ก๊าซมีตระกูล พลังงานพันธะจาก แรงดึงดูดไฟฟ้าสถิต ของสองประจุไออนที่ตรงข้ามกันมีค่าเป็นลบมากพอ เนื่องจากการที่พลังงานในสถานะที่เป็นพันธะโดยรวมต่ำกว่าสถานะที่ไม่เป็นพันธะ
พันธะไอออนิก (อังกฤษ: ionic bond) เกิดจากที่อะตอมหรือกลุ่มของอะตอมสร้างพันธะกันโดยที่อะตอมหรือกลุ่มของอะตอมให้อิเล็กตรอนกับอะตอมหรือกลุ่มของอะตอม ทำให้กลายเป็นประจุบวก ในขณะที่อะตอมหรือกลุ่มของอะตอมที่ได้รับอิเล็กตรอนนั้นกลายเป็นประจุลบ เนื่องจากทั้งสองกลุ่มมีประจุตรงกันข้ามกันจะดึงดูดกัน ทำให้เกิดพันธะไอออน โดยทั่วไปพันธะชนิดนี้มักเกิดขึ้นระหว่างโลหะกับอโลหะ โดยอะตอมที่ให้อิเล็กตรอนมักเป็นโลหะ ทำให้โลหะนั้นมีประจุบวก และอะตอมที่รับอิเล็กตรอนมักเป็นอโลหะ จึงมีประจุลบ ไอออนที่พันธะไอออนมีความแข็งแรงมากกว่าพันธะไฮโดรเจน แต่แข็งแรงพอ ๆ กับพันธะโคเวเลนต์
IUPAC นิยามพันธะไอออนิกว่าเป็น "พันธะระหว่างอะตอมที่มีอิเล็กโทรเนกาทิวิตีต่างกันอย่างมาก" ในที่นี้ พันธะไอออนิก หมายถึง แรงยึดเหนี่ยวทางไฟฟ้าสถิตที่เกิดขึ้นระหว่างประจุไฟฟ้าของไอออนบวกและไอออนลบ ซึ่งแตกต่างเปรียบเทียบกับพันธะโคเวเลนต์อย่างแท้จริง ในทางปฏิบัติ เรามักจะพิจารณาค่าความเป็นไอออนิกของพันธะ มากกว่าที่จะบอกว่าเป็นพันธะไอออนิกหรือพันธะโคเวเลนต์อย่างแท้จริง

สูตรชื่อธาตุ
ไปที่: ป้ายบอกทาง, ค้นหา
| เลขอะตอม | สัญลักษณ์ | ชื่อธาตุ |
ชื่อธาตุภาษาอังกฤษ
| ||
|---|---|---|---|---|---|
| 1 | H | ไฮโดรเจน | Hydrogen | ||
| D (²H) | ดิวเทอเรียม | Deuterium | |||
| T (³H) | ไตรเทียม | Tritium | |||
| 2 | He | ฮีเลียม | Helium | ||
| 3 | Li | ลิเทียม | Lithium | ||
| 4 | Be | เบริลเลียม | Beryllium | ||
| 5 | B | โบรอน | Boron | ||
| 6 | C | คาร์บอน | Carbon | ||
| 7 | N | ไนโตรเจน | Nitrogen | ||
| 8 | O | ออกซิเจน | Oxygen | ||
| 9 | F | ฟลูออรีน | Fluorine | ||
| 10 | Ne | นีออน | Neon | ||
| 11 | Na | โซเดียม | Sodium | ||
| 12 | Mg | แมกนีเซียม | Magnesium | ||
| 13 | Al | อะลูมิเนียม | Aluminium หรือ Aluminum | ||
| 14 | Si | ซิลิคอน | Silicon | ||
| 15 | P | ฟอสฟอรัส | Phosphorus | ||
| 16 | S | กำมะถัน หรือ ซัลเฟอร์ | Sulfur หรือ Sulphur | ||
| 17 | Cl | คลอรีน | Chlorine | ||
| 18 | Ar | อาร์กอน | Argon | ||
| 19 | K | โพแทสเซียม | Potassium | ||
| 20 | Ca | แคลเซียม | Calcium | ||
| 21 | Sc | สแกนเดียม | Scandium | ||
| 22 | Ti | ไทเทเนียม | Titanium | ||
| 23 | V | วาเนเดียม | Vanadium | ||
| 24 | Cr | โครเมียม | Chromium | ||
| 25 | Mn | แมงกานีส | Manganese | ||
| 26 | Fe | เหล็ก | Iron | ||
| 27 | Co | โคบอลต์ | Cobalt | ||
| 28 | Ni | นิกเกิล | Nickel | ||
| 29 | Cu | ทองแดง | Copper | ||
| 30 | Zn | สังกะสี | Zinc | ||
| 31 | Ga | แกลเลียม | Gallium | ||
| 32 | Ge | เจอร์เมเนียม | Germanium | ||
| 33 | As | สารหนู | Arsenic | ||
| 34 | Se | ซีลีเนียม | Selenium | ||
| 35 | Br | โบรมีน | Bromine | ||
| 36 | Kr | คริปทอน | Krypton | ||
| 37 | Rb | รูบิเดียม | Rubidium | ||
| 38 | Sr | สตรอนเชียม | Strontium | ||
| 39 | Y | อิตเตรียม | Yttrium | ||
| 40 | Zr | เซอร์โคเนียม | Zirconium | ||
| 41 | Nb | ไนโอเบียม | Niobium | ||
| 42 | Mo | โมลิบดีนัม | Molybdenum | ||
| 43 | Tc | เทคนิเซียม | Technetium | ||
| 44 | Ru | รูทีเนียม | Ruthenium | ||
| 45 | Rh | โรเดียม | Rhodium | ||
| 46 | Pd | แพลเลเดียม | Palladium | ||
| 47 | Ag | เงิน | Silver | ||
| 48 | Cd | แคดเมียม | Cadmium | ||
| 49 | In | อินเดียม | Indium | ||
| 50 | Sn | ดีบุก | Tin | ||
| 51 | Sb | พลวง | Antimony | ||
| 52 | Te | เทลลูเรียม | Tellurium | ||
| 53 | I | ไอโอดีน | Iodine | ||
| 54 | Xe | ซีนอน | Xenon | ||
| 55 | Cs | ซีเซียม | Caesium | ||
| 56 | Ba | แบเรียม | Barium | ||
| 57 | La | แลนทานัม | Lanthanum | ||
| 58 | Ce | ซีเรียม | Cerium | ||
| 59 | Pr | เพรซีโอดิเมียม | Praseodymium | ||
| 60 | Nd | นีโอดิเมียม | Neodymium | ||
| 61 | Pm | โพรมีเทียม | Promethium | ||
| 62 | Sm | ซามาเรียม | Samarium | ||
| 63 | Eu | ยูโรเปียม | Europium | ||
| 64 | Gd | กาโดลินเนียม | Gadolinium | ||
| 65 | Tb | เทอร์เบียม | Terbium | ||
| 66 | Dy | ดิสโพรเซียม | Dysprosium | ||
| 67 | Ho | โฮล์มเมียม | Holmium | ||
| 68 | Er | เออร์เบียม | Erbium | ||
| 69 | Tm | ทูเลียม | Thulium | ||
| 70 | Yb | อิตเตอร์เบียม | Ytterbium | ||
| 71 | Lu | ลูทีเชียม | Lutetium | ||
| 72 | Hf | ฮาฟเนียม | Hafnium | ||
| 73 | Ta | แทนทาลัม | Tantalum | ||
| 74 | W | ทังสเตน | Tungsten | ||
| 75 | Re | รีเนียม | Rhenium | ||
| 76 | Os | ออสเมียม | Osmium | ||
| 77 | Ir | อิริเดียม | Iridium | ||
| 78 | Pt | ทองคำขาวหรือแพลตินัม | Platinum | ||
| 79 | Au | ทอง | Gold | ||
| 80 | Hg | ปรอท | Mercury | ||
| 81 | Tl | ทาลเลียม | Thallium | ||
| 82 | Pb | ตะกั่ว | Lead | ||
| 83 | Bi | บิสมัท | Bismuth | ||
| 84 | Po | โปโลเนียม | Polonium | ||
| 85 | At | แอสทาทีน | Astatine | ||
| 86 | Rn | เรดอน | Radon | ||
| 87 | Fr | แฟรนเซียม | Francium | ||
| 88 | Ra | เรเดียม | Radium | ||
| 89 | Ac | แอคทิเนียม | Actinium | ||
| 90 | Th | ธอเรียม | Thorium | ||
| 91 | Pa | โพรแทคทิเนียม | Protactinium | ||
| 92 | U | ยูเรเนียม | Uranium | ||
| 93 | Np | เนปจูเนียม | Neptunium | ||
| 94 | Pu | พลูโตเนียม | Plutonium | ||
| 95 | Am | อเมริเซียม | Americium | ||
| 96 | Cm | คูเรียม | Curium | ||
| 97 | Bk | เบอร์คีเลียม | Berkelium | ||
| 98 | Cf | แคลิฟอร์เนียม | Californium | ||
| 99 | Es | ไอน์สไตเนียม | Einsteinium | ||
| 100 | Fm | เฟอร์เมียม | Fermium | ||
| 101 | Md | เมนเดลเลเวียม | Mendelevium | ||
| 102 | No | โนเบลเลียม | Nobelium | ||
| 103 | Lr | ลอว์เรนเซียม | Lawrencium | ||
| 104 | Rf | รูเทอร์ฟอร์เดียม | Rutherfordium | ||
| 105 | Db | ดุบเนียม | Dubnium | ||
| 106 | Sg | ซีบอร์เกียม | Seaborgium | ||
| 107 | Bh | โบห์เรียม | Bohrium | ||
| 108 | Hs | ฮัสเซียม | Hassium | ||
| 109 | Mt | ไมต์เนเรียม | Meitnerium | ||
| 110 | Ds | ดาร์มสตัดเทียม | Darmstadtium | ||
| 111 | Rg | เรินต์เกเนียม | Roentgenium | ||
| 112 | Uub | อุนอุนเบียม | Ununbium | ||
| 113 | Uut | อุนอุนเตรียม | Ununtrium | ||
| 114 | Uuq | อุนอุนควอเดียม | Ununquadium | ||
| 115 | Uup | อุนอุนเพนเทียม | Ununpentium | ||
| 116 | Uuh | อุนอุนเฮ็กเซียม | Ununhexium | ||
| 117 | Uus | อุนอุนเซปเทียม | Ununseptium | ||
| 118 | Uuo | อุนอุนออคเทียม | Ununoctium |
ตารางธาตุ
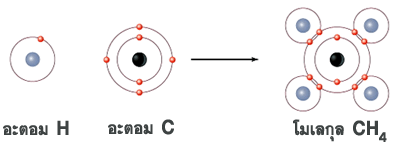
ส่วนประกอบของอะตอม คือ อิเล็กตรอน (e) โปรตอน (p) และนิวตรอน (n) โปรตอนและนิวตรอนอยู่ตรงกลาง คือนิวเคลียส อิเล็กตรอนเคลื่อนที่วนอยู่รอบนิวเคลียส
ธาตุ คือ สสารที่โมเลกุลประกอบด้วยอะตอมชนิดเดียวกัน เช่น โมเลกุลของก๊าซออกซิเจน (O2) ประกอบด้วยอะตอมของธาตุออกซิเจน 2 อะตอม
สัญลักษณ์ของธาตุ หมายถึง เครื่องหมายซึ่งใช้แทนชื่อธาตุเพื่อให้เข้าใจตรงกันเป็นสากล
สัญลักษณ์ของธาตุที่เป็นรูปภาพ ซึ่งจอห์น ดอลตัล เป็นคนแรกที่เสนอให้ใช้รูปภาพแทนชื่อธาตุ
สัญลักษณ์ของธาตุที่เป็นตัวอักษร ซึ่ง โจนส์ จาคอบ เบอร์ซีเลียส เป็นผู้เสนอให้ใช้ตัวอักษรแทนชื่อธาตุและเป็นที่ยอมรับกันในปัจจุบัน โดยมีหลักการเขียนดังนี้
1. ถ้าธาตุนั้นมีชื่อภาษาละติน ให้นำตัวอักษรตัวแรกมาเขียนด้วยอักษรภาษาอังกฤษ ตัวพิมพ์ใหญ่เป็นสัญลักษณ์ของธาตุนั้น ถ้าอักษรตัวแรกซ้ำกับธาตุอื่นให้เพิ่มตัวอักษรตัวถัดไปตัวใดตัวหนึ่งเขียนด้วยตัวพิมพ์เล็ก เช่น ธาตุโพแทสเซียม ชื่อภาษาละติน Kalium สัญลักษณ์ของธาตุ คือ K ธาตุเงิน ชื่อภาษาละติน Argentum สัญลักษณ์ของธาตุ คือ Ag
2. ถ้าธาตุนั้นไม่มีชื่อเป็นภาษาละติน ให้ใช้ชื่อภาษาอังกฤษ โดยมีหลักการเขียนสัญลักษณ์ เหมือนเดิม เช่น ธาตุคาร์บอน ชื่อภาษาอังกฤษ Carbon สัญลักษณ์ของธาตุ คือ C
วันอังคารที่ 29 กรกฎาคม พ.ศ. 2557
เนื้อหาสูตรเคมี
สูตรเคมี หมายถึง สัญลักษณ์ที่ใช้เขียนแทนธาตุหรือสารประกอบเพื่อแสดงองค์ประกอบ ของสารเหล่านั้นว่าประกอบด้วยธาตุใดบ้างอย่างละเท่าใดหรือเป็นอัตราส่วนเท่าใด สูตรบางประเภทยังให้รายละเอียดเพิ่มเติมเกี่ยวกับการจัดเรียงอะตอมภายในโมเลกุลด้วย
สูตรเคมีแบ่งเป็น 3 ประเภท คือ
น้ำ มีสูตรโมเลกุลเป็น H2O หมายความว่า น้ำ 1 โมเลกุล ประกอบด้วยไฮโดรเจน 2 อะตอม และ ออกซิเจน 1 อะตอม
เอทานอล มีสูตรโมเลกุลเป็น C2H6O หมายความว่า เอทานอล 1 โมเลกุล ประกอบด้วย
คาร์บอน 2 อะตอม ไฮโดรเจน 6 อะตอม และ ออกซิเจน 1 อะตอม
กรดซัลฟิวริก มีสูตรโมเลกุลเป็น H2SO4 หมายความว่า กรดซัลฟิวริก 1 โมเลกุล ประกอบด้วย
ไฮโดรเจน 2 อะตอม , ซัลเฟอร์ 1 อะตอม และ ออกซิเจน 4 อะตอม
แคลเซียมฟอสเฟต มีสูตรโมเลกุลเป็น Ca3(PO4 )2 หมายความว่า แคลเซียมฟอสเฟต 1 โมเลกุล ประกอบด้วยแคลเซียม 3 อะตอม , ฟอสฟอรัส 1 X 2 =2 อะตอม และ ออกซิเจน 4 X 2 =8 อะตอม
ตัวอย่างอื่น ๆ ของสูตรโมเลกุล ได้แก่
น้ำตาลกลูโคส มีสูตรโมเลกุล C6H12O6
น้ำ มีสูตรโมเลกุล H2O
โพรเพน มีสูตรโมเลกุล C3H8
เบนซีน มีสูตรโมเลกุล C6H6
2. สูตรเอมพิริคัลหรือสูตรอย่างง่าย (Empirical formular) เป็นสูตรที่เขียนขึ้นเพื่อแสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุใดบ้าง ขณะเดียวกันก็ยังแสดงอัตราส่วนอย่างต่ำที่สุดของจำนวนอะตอมที่ปรากฏในสูตรนั้นด้วย ส่วนใหญ่ใช้แสดงสูตรของสารประกอบไอออนิกซึ่งไม่มีสูตรโมเลกุลที่แน่นอน
เช่น โซเดียมคลอไรด์มีสูตรเป็น NaCl
นอกจากนี้ยังอาจใช้แสดงอัตราส่วนอย่างต่ำของสารโคเวเลนต์ด้วย
เช่น ไฮโดรเจนเปอร์ออกไซด์ มีสูตรเป็น H2O2 มีสูตรเอมพิริคัลเป็น HO
ตัวอย่าง O = C = O เป็นสูตรโครงสร้างของคาร์บอนไดออกไซด์ (CO2) ซึ่งบอกให้ทราบว่าหนึ่งโมเลกุลของคาร์บอนไดออกไซด์ ประกอบด้วย C 1 อะตอม และ O 2 อะตอม ระหว่าง C และ O ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ชนิดพันธะคู่
สูตรเคมีแบ่งเป็น 3 ประเภท คือ
1. สูตรโมเลกุล (Molecular) เป็นสูตรที่เขียนขึ้นเพื่อแสดงให้ทราบว่าสารนั้น 1 โมเลกุลประกอบด้วย ธาตุใดบ้างอย่างละกี่อะตอม เช่น
น้ำ มีสูตรโมเลกุลเป็น H2O หมายความว่า น้ำ 1 โมเลกุล ประกอบด้วยไฮโดรเจน 2 อะตอม และ ออกซิเจน 1 อะตอม
เอทานอล มีสูตรโมเลกุลเป็น C2H6O หมายความว่า เอทานอล 1 โมเลกุล ประกอบด้วย
คาร์บอน 2 อะตอม ไฮโดรเจน 6 อะตอม และ ออกซิเจน 1 อะตอม
กรดซัลฟิวริก มีสูตรโมเลกุลเป็น H2SO4 หมายความว่า กรดซัลฟิวริก 1 โมเลกุล ประกอบด้วย
ไฮโดรเจน 2 อะตอม , ซัลเฟอร์ 1 อะตอม และ ออกซิเจน 4 อะตอม
แคลเซียมฟอสเฟต มีสูตรโมเลกุลเป็น Ca3(PO4 )2 หมายความว่า แคลเซียมฟอสเฟต 1 โมเลกุล ประกอบด้วยแคลเซียม 3 อะตอม , ฟอสฟอรัส 1 X 2 =2 อะตอม และ ออกซิเจน 4 X 2 =8 อะตอม
ตัวอย่างอื่น ๆ ของสูตรโมเลกุล ได้แก่
น้ำตาลกลูโคส มีสูตรโมเลกุล C6H12O6
น้ำ มีสูตรโมเลกุล H2O
โพรเพน มีสูตรโมเลกุล C3H8
เบนซีน มีสูตรโมเลกุล C6H6
2. สูตรเอมพิริคัลหรือสูตรอย่างง่าย (Empirical formular) เป็นสูตรที่เขียนขึ้นเพื่อแสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุใดบ้าง ขณะเดียวกันก็ยังแสดงอัตราส่วนอย่างต่ำที่สุดของจำนวนอะตอมที่ปรากฏในสูตรนั้นด้วย ส่วนใหญ่ใช้แสดงสูตรของสารประกอบไอออนิกซึ่งไม่มีสูตรโมเลกุลที่แน่นอน
เช่น โซเดียมคลอไรด์มีสูตรเป็น NaCl
นอกจากนี้ยังอาจใช้แสดงอัตราส่วนอย่างต่ำของสารโคเวเลนต์ด้วย
เช่น ไฮโดรเจนเปอร์ออกไซด์ มีสูตรเป็น H2O2 มีสูตรเอมพิริคัลเป็น HO
กรดซัลฟิวริก มีสูตรโมเลกุลเป็น H2SO4 หมายความว่า กรดซัลฟิวริก 1 โมเลกุลประกอบด้วย
ธาตุ H , S และ O โดยมีอัตราส่วนอย่างต่ำของจำนวนอะตอม H : S : O = 2 : 1 : 4
น้ำตาลกลูโคส มีสูตรโมเลกุลเป็น C6H12O6 หมายความว่า น้ำตาลกลูโคส 1 โมเลกุล ประกอบด้วย
ธาตุ C , H และ O โดยมีอัตราส่วนอย่างต่ำของจำนวนอะตอม C : H : O = 1 : 2 : 1
เอทานอล มีสูตรโมเลกุลเป็น C2H6O หมายความว่า เอทานอล 1 โมเลกุล ประกอบด้วย
ธาตุ C , H และ O โดยมีอัตราส่วนอย่างต่ำของจำนวนอะตอม C : H : O = 2 : 6 : 1
ธาตุ H , S และ O โดยมีอัตราส่วนอย่างต่ำของจำนวนอะตอม H : S : O = 2 : 1 : 4
น้ำตาลกลูโคส มีสูตรโมเลกุลเป็น C6H12O6 หมายความว่า น้ำตาลกลูโคส 1 โมเลกุล ประกอบด้วย
ธาตุ C , H และ O โดยมีอัตราส่วนอย่างต่ำของจำนวนอะตอม C : H : O = 1 : 2 : 1
เอทานอล มีสูตรโมเลกุลเป็น C2H6O หมายความว่า เอทานอล 1 โมเลกุล ประกอบด้วย
ธาตุ C , H และ O โดยมีอัตราส่วนอย่างต่ำของจำนวนอะตอม C : H : O = 2 : 6 : 1
ตัวอย่างของสูตรเอมพิริคัล ได้แก่
น้ำตาลกลูโคส มีสูตรเอมพิริคัล CH2O
น้ำ มีสูตรเอมพิริคัล H2O
โพรพีน มีสูตรเอมพิริคัล CH2
เบนซีน มีสูตรเอมพิริคัล CH
น้ำตาลกลูโคส มีสูตรเอมพิริคัล CH2O
น้ำ มีสูตรเอมพิริคัล H2O
โพรพีน มีสูตรเอมพิริคัล CH2
เบนซีน มีสูตรเอมพิริคัล CH
สูตรโมเลกุลเป็นสูตรที่แสดงจำนวนอะตอมทั้งหมดใน 1 โมเลกุล ในขณะที่สูตร
เอมพิริคัลแสดงอัตราส่วนอย่างต่ำของจำนวนอะตอมใน 1 โมเลกุล จะเห็นได้ว่าถ้าหากทราบสูตรโมเลกุลจะทำให้ทราบสูตรเอมพิริคัล เนื่องจากสูตรทั้งสองประเภทมีส่วนสัมพันธ์กันดังนี้
สูตรโมเลกุล = (สูตรเอมพิริคัล) n เมื่อ n คือเลขจำนวนเต็ม = 1, 2, 3, 4…..
3. สูตรโครงสร้าง (Structural formular) เป็นสูตรที่เขียนขึ้นเพื่อแสดงให้ทราบว่าสารนั้น 1 โมเลกุล ประกอบด้วย ธาตุใดบ้างอย่างละกี่อะตอม และอะตอมใดเกาะเกี่ยวอยู่กับอะตอมใดด้วยพันธะชนิดใด
เอมพิริคัลแสดงอัตราส่วนอย่างต่ำของจำนวนอะตอมใน 1 โมเลกุล จะเห็นได้ว่าถ้าหากทราบสูตรโมเลกุลจะทำให้ทราบสูตรเอมพิริคัล เนื่องจากสูตรทั้งสองประเภทมีส่วนสัมพันธ์กันดังนี้
สูตรโมเลกุล = (สูตรเอมพิริคัล) n เมื่อ n คือเลขจำนวนเต็ม = 1, 2, 3, 4…..
3. สูตรโครงสร้าง (Structural formular) เป็นสูตรที่เขียนขึ้นเพื่อแสดงให้ทราบว่าสารนั้น 1 โมเลกุล ประกอบด้วย ธาตุใดบ้างอย่างละกี่อะตอม และอะตอมใดเกาะเกี่ยวอยู่กับอะตอมใดด้วยพันธะชนิดใด
ตัวอย่าง O = C = O เป็นสูตรโครงสร้างของคาร์บอนไดออกไซด์ (CO2) ซึ่งบอกให้ทราบว่าหนึ่งโมเลกุลของคาร์บอนไดออกไซด์ ประกอบด้วย C 1 อะตอม และ O 2 อะตอม ระหว่าง C และ O ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ชนิดพันธะคู่
สารประกอบเกิดขึ้นจากการแลกเปลี่ยนอนุภาคมูลฐานภายในอะตอม เพื่อให้อยู่ในสภาพที่เสถียรหรือสมดุล จึงเกิดเป็นโมเลกุลและสูตรสารเคมีต่างๆ ดังภาพ
น้ำ (H2O) ประกอบด้วยธาตุไฮโดรเจน และออกซิเจน โดยมีอัตราส่วนโดยอะตอมของ H : O = 2 : 1, มีอัตราส่วนโดยมวลของ H : O = 1 : 8 และ มีอัตราส่วนโดยปริมาตรของ H : O = 2 : 1
คาร์บอนไดออกไซด์ (CO2) ประกอบด้วยธาตุคาร์บอนและออกซิเจน โดยมีอัตราส่วนโดยอะตอมของ C : O = 1 : 2 และ มีอัตราส่วนโดยมวลของ C : O = 3 : 8
ดังนั้น สูตรเคมี คือ กลุ่มของสัญลักษณ์ธาตุที่เขียนขึ้นเพื่อแสดงจำนวนอะตอมของธาตุที่เป็นองค์ประกอบของสาร สูตรเคมีที่แสดงชนิดของธาตุและจำนวนอะตอมที่เป็นองค์ประกอบใน 1 โมเลกุล เรียกว่า "สูตรโมเลกุล" ดังตัวอย่างสูตรโมเลกุลของสารประกอบต่อไปนี้ ตัวอย่างสูตรโมเลกุลของสารประกอบ
แมงกาเนต
สมัครสมาชิก:
บทความ (Atom)